作者:顾泱丨尤鹏飞丨郑杜之韵丨张玉臻丨于逢祺[1]
2023年9月7日,国家药监局药品审评中心(CDE)发布了《中国新药注册临床试验进展年度报告(2022年)》(“《2022年年度报告》”)。相较于历年发布的《中国年度药品审评报告》(本所关于2015 – 2021年度药品审评报告的解读文章请参见:汉坤 • 观点 | 中国年度药品审评报告解读(2015 – 2021) — 回顾我国药品审评审批制度改革成果(上篇、中篇、下篇))中对药品审评情况的关注,该报告着力于根据药物临床试验登记与信息公示平台的信息,对2022年中国新药注册临床试验情况进行统计和分析。本文将主要从临床试验登记数量、申办者类型、药物类型和品种、目标适应症、国内外分布、分期、组长单位和参加单位、特殊人群药物的临床试验、以及登记启动和完成用时情况等9个方面总结本次《2022年年度报告》的要点,以此呈现我国目前新药临床试验的现状,并展望未来新药临床试验的发展方向。
一、临床试验登记数量
从登记总数来看,以在药物临床试验登记与信息公示平台登记的数量为准,2022年登记的临床试验总量达3,410项,为近年以来最多。综合2019年至2022年登记总数来看,我国临床试验数量在2021年曾出现大幅提升。2022年受资本降温影响,增速有所放缓,但仍有小幅增长。2019年到2022年的药物临床试验登记与信息公示平台年度登记总量变化如下表:
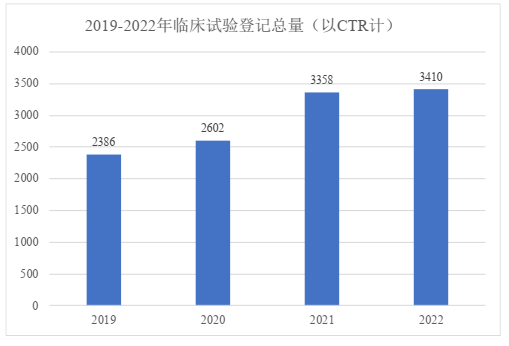
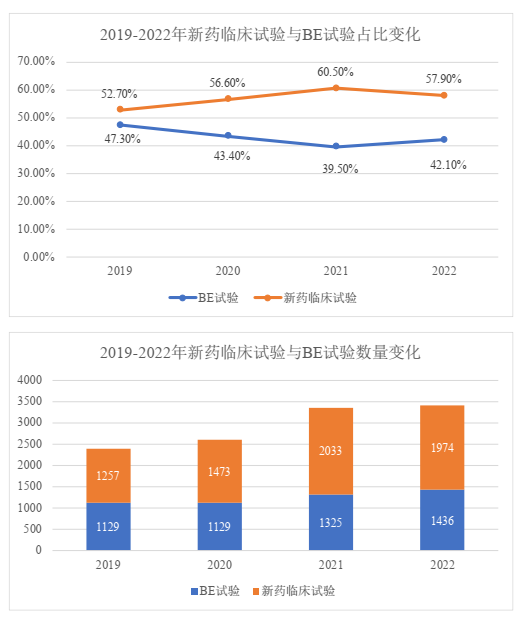
按临床试验类型分析,较前年相比,新药临床试验的数量和占比均有所下降,而生物等效性(BE)试验在数量上则仍然保持稳定与增长趋势。我们理解,新药临床试验所需成本往往更高,而受经济形势影响,研发企业的资金短缺导致其能够开展新药临床试验项目数量收紧。
二、申办者类型
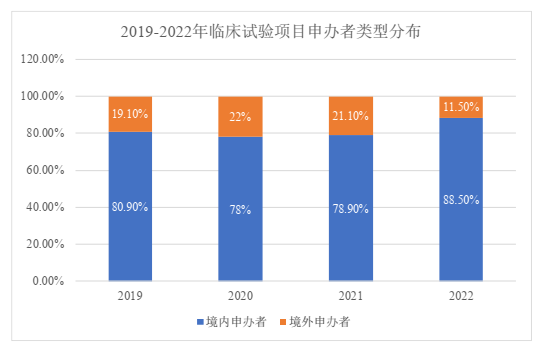
从申办者类型来看,我国登记的临床试验一直以来都以境内申办者为主。2022年,境内申办者的项目占比高达88.5%。境外申办者项目数量在2019 – 2021年有所上升,但是在2022年出现了大幅下降,其占比甚至低于2019年的境外申办者占比(19.10%),体现出2022年度登记的临床试验中仍以国内申办者为主,且其占比正在显著扩大。
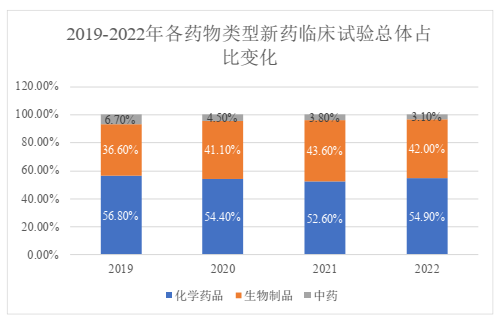
三、各药物类型品种
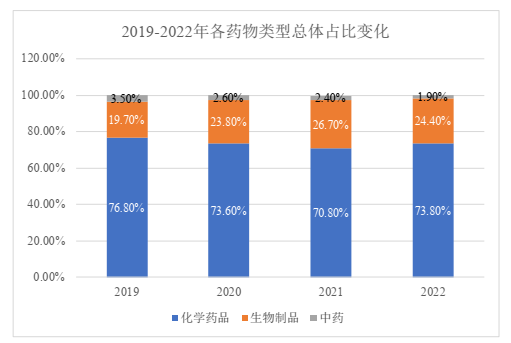
以化学药品、生物制品和中药的药物类型为区分,总体而言,我国药物临床试验仍以化学药品为主,占比高达73.8%,其次为生物制品,中药临床试验数量则依然占比非常少,仅为1.9%。其中,新药临床试验的占比情况与之类似,也以化学药品为主,占比超过50%,其次为生物制品,占比42.0%,中药仅占3.1%。
值得一提的是,2019 – 2021年期间,我国生物制品临床试验总体占比和新药临床试验占比均呈现逐年递增的趋势,然而在2022年却都出现了回落。我们推测,这一方面可能是由于市场需求的变化导致了新冠疫苗项目的减少,另一方面也可能与我国出台政策强调药物临床研发要以患者需求为核心、以临床价值为导向,在一定程度上打压了一批临床价值不占优势、创新程度不明显的me-too药物的研发。
关于新药临床试验品种,按照上述不同药物类型区分,2022年化学药品临床试验数量前10位的品种共登记77项试验,占化学药品总体的7.1%,其中单一品种开展试验数量最多的为6项。生物制品临床试验数量前10位的品种共登记86项试验,占生物制品总体的10.4%,其中单一品种开展临床试验数量最多的为9项。多数中药品种则基本上只开展了1项临床试验。
一直以来,扎堆重复研发、同质化严重是我国药物研发所面临的问题,这也导致我国药物研发创新质量不高、无法真正满足患者需求的困境。为了缓解这一现象,我国出台了相关政策和指导原则(如CDE于2021年11月发布的《以临床价值为导向的抗肿瘤药物临床研发指导原则》),要求药物临床研发以患者需求为核心、以临床价值为导向,以期提高新药研发的门槛。根据CDE近三年发布的数据,2020年和2021年有不少新药品种开展的临床试验数量高达10 – 20项,这一现象在22年已经有所改善。
关于细胞和基因治疗(CGT)品种,2022年我国共登记了46项CGT产品类临床试验,共涉及41个品种。其中,从目标适应症来看以抗肿瘤药物为主,从试验分期来看则是以早期(I期)项目为主。
对于BE试验品种,单个品种的临床试验数量依然十分拥挤,排名前十位的品种临床试验数量均超过了10项,最多的有18项。
四、目标适应症
与往年无明显变化,2022年我国化学药和生物制品临床试验项目的目标适应症仍然以抗肿瘤药物为主,分别占化学药品临床试验总数的36.7%和生物制品临床试验总数的48.1%。中药临床试验的目标适应症则主要集中在呼吸、消化、皮肤及五官、精神神经和妇科等5个适应症上。近年来,我国肿瘤药物研发临床试验扎堆、同质化严重引起了业界广泛关注。如何走出“内卷”,真正以患者的需求和临床价值为导向,进行高水平、差异化创新,是研发人员、药企和投资机构等业内主体需要继续探索和努力的方向。
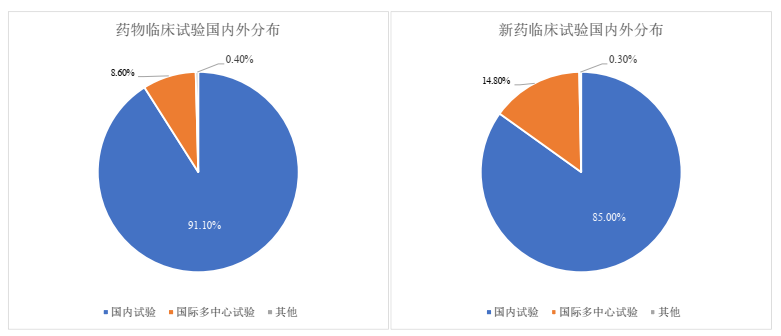
五、临床试验的国内外分布
2022年,我国药物临床试验在整体上仍以国内项目为主,占比91.1%,国际多中心试验仅占8.6%。而在新药临床试验中,国际多中心试验的占比相对而言较高一些,达到了14.8%。我国2016年发布的《化学药品注册分类改革工作方案》和2020年颁布的《药品注册管理办法(2020)》对化学药品的注册分类进行了调整。与2007年的注册分类要求相比,对新药的定义从“中国新”转变为“全球新”,即新药必须在境内外均未上市。我们推测,这一变化激励并促使了更多跨国药企选择在中国同步开展药物研发活动和临床试验,也在推动新药国际多中心试验的开展。
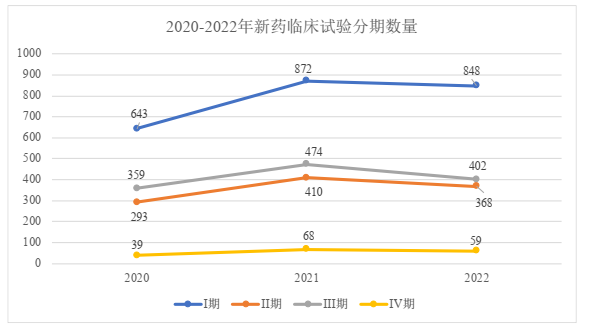
六、临床试验分期分布
2022年,我国新药各期临床试验数量占总量的占比情况与往年基本保持一致,I期试验占比最高,达43.0%,其次为III期(20.4%)和II期(18.6%),IV期试验占比最低。在资本降温下,2022年我国新药的各期临床试验的数量均有所下降。我们理解,由于资金压力或经营策略趋于谨慎,部分企业倾向选择将钱花在刀刃上,仅保留其核心管线,而对未取得良好临床表现、市场规模不大的非核心管线进行削减。
七、组长单位和参加单位
从临床试验机构所在地分布来看,我国近几年来作为组长单位参加临床试验次数最多的地区一直主要集中在北京市、上海市、广东省和江苏省等,其中北京市的临床试验机构作为组长单位参加临床试验的次数最多。临床试验参加单位则主要集中在广东省、北京市、江苏省和浙江省,其中广东省为参加单位次数最多的地区。2022年国外机构参与我国临床试验的占比为41%。
从《2022年年度报告》的数据可以看出,目前我国临床试验在地域分布上依然存在不均衡现象。2019年《药品管理法》修订前,我国药物临床试验机构的管理实行的是资质认定制,在2019年《药品管理法》修订后则改为了备案管理。我们理解,这一变化是为了鼓励和便利更多的医疗机构参与临床试验项目。然而,可能受限于资金、研究人员等多方面的综合因素,实践中临床试验机构的分布在地域上依然差异较大。
同时,结合临床试验项目的启动用时来看,临床试验组长单位较多的地区,其临床试验的启动用时往往较长,而在组长单位较少的地区(如海南省、辽宁省等)临床试验的启动效率更高。我们理解,这一方面是在一定程度上反映出我国临床资源供需存在不平衡现象,另一方面还可能是由于优秀、有经验的临床试验机构堆积的项目也多,因此项目的启动往往也需要排队。
八、特殊人群药物临床试验
特殊人群药物临床试验主要指的是老年人群药物临床试验、儿童人群药物临床试验和罕见病药物临床试验。在2022年药物临床试验中,老年人群的参加比例较高,含老年人受试者的临床试验在新药临床试验中占比为72.3%,但仅在老年人群中开展的项目仅有1项。相比之下,儿童人群的参加比例较低,含儿童受试者的临床试验在新药临床试验中占比仅为8.3%,而仅在儿童人群中开展的项目则共登记有64项。近年来,罕见病药物临床试验数量呈逐年递增的趋势,2022年共登记68项。
老年人、儿童和罕见病患者是我国近年来重点鼓励和关注的用药人群,作为社会中较为弱势的群体,这些特殊人群用药的安全性、有效性和可及性应是社会关注的重点问题和社会保障的重要方面。尤其是儿童用药和罕见病药物通常具有研发难度大、周期长、成本高的特点,导致企业研发动力不足。我国近年来为了鼓励儿童用药和罕见病药物的研发,也出台了包括优先审评审批制度在内的一系列政策,以期提高企业的研发热情。我们也期待未来我国特殊人群参与临床试验的比例能够进一步提高。
九、登记用时、启动用时以及完成情况
(一)登记用时
针对自首次提交临床试验登记至获得临床试验默示许可/BE备案的登记用时,新药临床试验受理号登记平均用时为116天,最高不超过328天,过半数的受理号登记需要超过2个月的时间完成登记并提交;BE试验备案登记平均用时为67天,最高不超过221天,多数BE备案在1 – 2个月内完成登记并提交。可见,总体上新药临床试验登记的用时相较于BE备案登记显著较长。
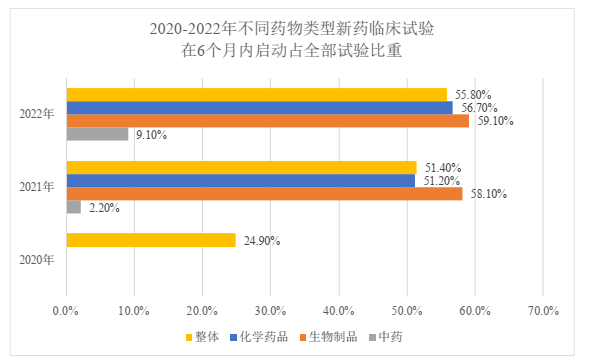
(二)启动用时
针对临床试验获批日期到国内首例知情同意(ICF)日期的耗时(即启动用时),2022年平均用时为48个月,最多用时为207个月。但总体上,不同的药物类型中已有更多的药品可以在6个月内启动受试者招募,2022年已有过半数(55.8%)的临床试验可以在6个月内启动受试者招募,其中过半数化学药(56.7%)和生物制品(59.1%)均可在6个月内启动受试者招募,而中药1年内启动受试者招募的仅有21.2%,但相比于2021年的数据(4.4%)已经有显著的提升。如我们先前的解读文章所提到的(本所关于中药临床试验的分析文章请参见:汉坤 • 观点 | 中药之春?从《中药注册管理专门规定》看中药特色上市评价体系),中药的临床试验在临床定位和疗效评价,以及人用经验的收集应用等具有特殊性,中药临床试验的件数少和实施效率低也已经在《2022年年度报告》中被明确列为需要关注的问题,如何提升中药临床试验的实施效率,鼓励企业继续深入中药传承创新也值得我们后续持续关注。
(三)完成情况与完成用时
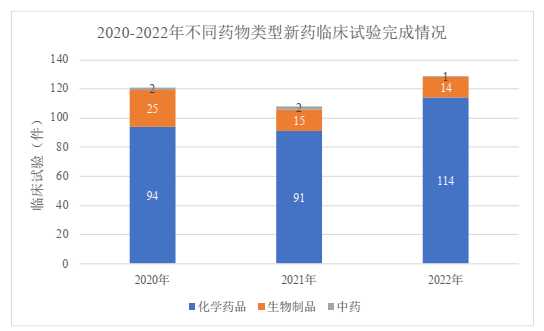
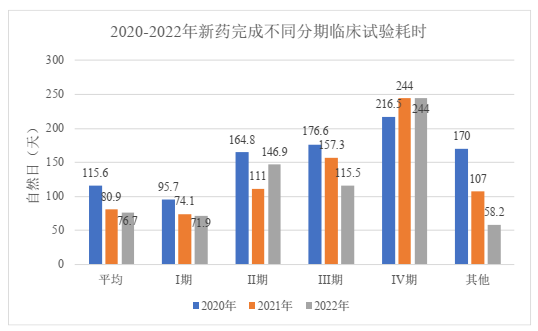
针对临床试验的完成情况,2022年共计完成临床试验129项,相比起2021年(108项)和2020年(121项)均有所上升。2022年,国内首例ICF日期到国内临床试验完成日期(即完成用时)的平均用时为76.7天,最高不超过258天,较2021年(平均80.9天)和2020年(平均115.6天)均有所缩短;其中完成的临床试验以I期临床试验为主(占72.9%),平均用时71.9天,IV期临床试验平均用时则达到244天。
根据《2022年年度报告》,2022年主动暂停9项临床试验,主动终止16项临床试验,同时也列举了该等试验暂停/终止的原因,其中研发策略调整已经连续第二年成为涉及数量最多的暂停/终止原因,其他的原因包括方案设计、临床获益有限、生产工艺问题、试验质量问题、试验经费问题、安全性风险等。
十、结语
近几年来,我国新药临床试验项目受制于资本领域疲软等环境和背景的影响,发展速度有所放缓。除此之外,《2022年年度报告》也体现出我国新药临床试验中有多项问题仍未得到解决,开展临床试验药品的同质化现象仍然显著,开展临床试验项目的机构的地域分布仍然较为集中,也制约着临床试验的启动效率,而中药发展在近年受到重点扶持的前提下,临床试验的数量和实施效率仍有待进一步的提升。但同时我们也注意到,随着我国药品创新发展的增速不断加快,截至2023年上半年新药临床试验项目已经显现出快速增长的趋势,临床试验的启动和推进效率也得到了一定程度的改善,新的临床试验形式(如去中心化临床试验,本所关于去中心化临床试验的分析文章请参见:汉坤 • 观点 | 中国DCT(去中心化临床试验)的实施与监管)也在被积极的探索和受到支持。总体而言我国新药临床试验的情况仍然呈现出积极向好的发展方向。未来如何解决该报告中提到的的上述既有问题并进一步提升我国新药临床试验的数量、效率和质量,需要主管机关在政策层面以及企业在实施层面的共同努力,对于未来我国临床试验的发展和监管的最新动态,我们也将同业界一道持续关注。
特别声明 |
|
汉坤律师事务所编写《汉坤法律评述》的目的仅为帮助客户及时了解中国或其他相关司法管辖区法律及实务的最新动态和发展,仅供参考,不应被视为任何意义上的法律意见或法律依据。 如您对本期《汉坤法律评述》内容有任何问题或建议,请与汉坤律师事务所以下人员联系: |
|
顾泱 电话: +86 21 6080 0505 |
[1] 实习生王乐怡、孙舒闻对本文的写作亦有贡献。